POBIERZ ARKUSZ: MATURA 2014 CHEMIA - POZIOM PODSTAWOWY
POZIOM ROZSZERZONY TUTAJ: Matura 2014: Chemia - poziom rozszerzony [ODPOWIEDZI, ARKUSZE CKE]
MATURA 2014 CHEMIA - POZIOM PODSTAWOWY - ODPOWIEDZI:
ZADANIE 1
ZADANIE 2
Na poniższym schemacie układu okresowego pierwiastków (bez lantanowców i aktynowców) zaznaczono położenie trzech pierwiastków oznaczonych numerami I, II oraz III.
Wypełnij tabelę, wpisując literę P, jeżeli informacja jest prawdziwa, lub literę F, jeżeli jest fałszywa.
1. Pierwiastek I jest aktywnym metalem. Reaguje z wodą, w wyniku czego tworzy się wodorotlenek o wzorze ogólnym MeOH, który jest mocną zasadą. PRAWDA
2. Pierwiastki II i III są niemetalami. Pierwiastek III jest aktywniejszy od pierwiastka II. FAŁSZ
3. Wodorki pierwiastków II i III mają wzór ogólny HX. Są rozpuszczalne w wodzie, w której ulegają dysocjacji jonowej, w wyniku czego tworzą się roztwory o odczynie kwasowym. PRAWDA
ZADANIE 3
ZADANIE 4
Podczas prażenia mieszaniny tlenku ołowiu(II) i siarczku ołowiu(II) bez dostępu powietrza zachodzi reakcja zgodnie ze schematem:
PbO + PbS ---> Pb + SO2
a) Uzgodnij współczynniki w równaniu reakcji chemicznej zachodzącej podczas prażenia mieszaniny PbO i PbS bez dostępu powietrza. Zastosuj metodę bilansu elektronowego.
Bilans elektronowy:
Zbilansowane równanie reakcji:

b) Określ funkcję, jaką w tej reakcji pełni siarka w siarczku ołowiu(II).
Siarka w siarczku ołowiu(II) pełni funkcję reduktora
ZADANIE 5
ZADANIE 6
Napisz w formie cząsteczkowej równanie reakcji cyny z chlorem.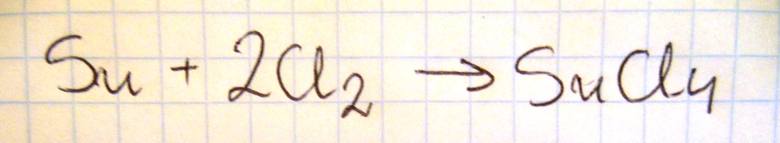
ZADANIE 7
Napisz w formie jonowej równanie reakcji cyny z kwasem solnym.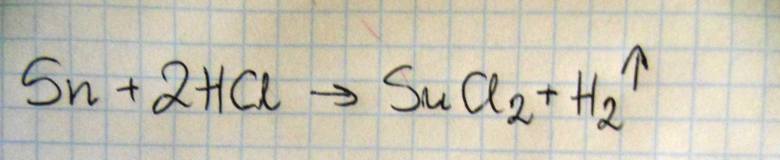
ZADANIE 8
Szereg aktywności metali tworzą metale i wodór ułożone według ich podatności na utlenianie, czyli według zdolności tworzenia jonów naładowanych dodatnio. Każdy pierwiastek jest reduktorem kationów wszystkich pierwiastków położonych po jego prawej stronie w tym szeregu. Poniżej przedstawiono fragment szeregu aktywności metali.
a)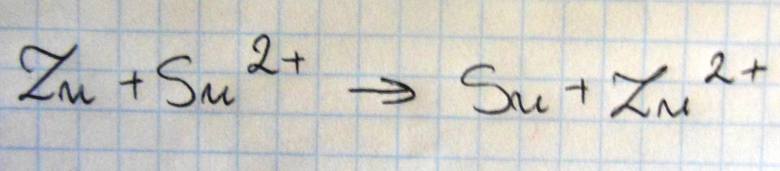
b)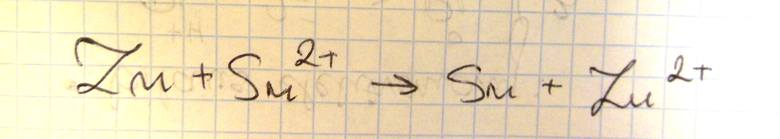
ZADANIE 9
Cyna występuje w postaci dwóch odmian: cyny szarej i cyny białej. Cyna biała jest metalem srebrzystobiałym, ciągliwym i kowalnym, cyna szara tworzy szary proszek. Cyna biała jest trwała w temperaturze powyżej 13,4 °C, cyna szara jest trwała poniżej tej temperatury.
1. W temperaturze 25 °C cyna występuje w postaci cyny białej, a w temperaturze 5 °C – w postaci cyny szarej. PRAWDA
2. Występowanie cyny w postaci dwóch odmian – cyny szarej i cyny białej – wpływa na wartość jej masy atomowej. FAŁSZ
3. Tworzenie ubytków w wyrobach cynowych może być spowodowane długotrwałym przechowywaniem tych wyrobów w temperaturze niższej niż 13,4 °C. PRAWDA
ZADANIE 10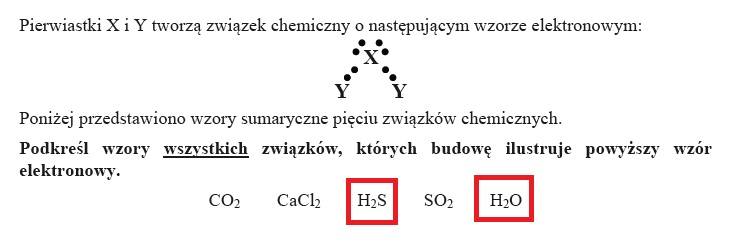
ZADANIE 11
ZADANIE 12
Uzupełnij poniższe zdania. Wybierz i podkreśl jedno określenie spośród podanych w nawiasach.
1. Rozpuszczalność tlenu i tlenku siarki(IV) (maleje/ rośnie / nie zmienia się )w miarę obniżania temperatury.
2. Tlen (jest dobrze / jest słabo[/b / nie jest) rozpuszczalny w wodzie.
[b]ZADANIE 13
Określ odczyn wodnych roztworów tlenu i tlenku siarki(IV).
1. Odczyn wodnego roztworu tlenu: obojętny
2. Odczyn wodnego roztworu tlenku siarki(IV): kwasowy
ZADANIE 14
Napisz w formie cząsteczkowej równanie reakcji tlenku siarki(IV) z wodą.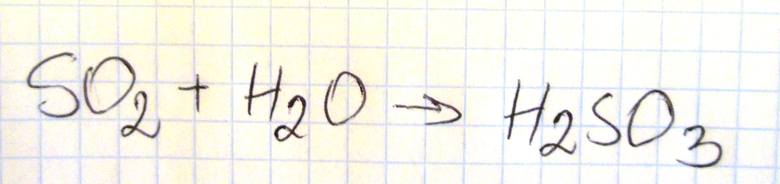
ZADANIE 15
Uzupełnij poniższe zdanie. Wybierz i podkreśl jedno określenie spośród podanych w każdym nawiasie.
Gazem, który słabiej rozpuszcza się w wodzie, jest (tlenek siarki(IV) /tlen), ponieważ (ma mniejszą gęstość / jego cząsteczki są polarne / nie reaguje z wodą).
ZADANIE 16
ZADANIE 17
Do wodnego roztworu siarczanu(VI) miedzi(II) o barwie niebieskiej dodano bezbarwny wodny roztwór wodorotlenku sodu.
a) Opisz zmianę, jaką zaobserwowano po zmieszaniu roztworów. Uwzględnij stan skupienia i barwę powstałego związku miedzi(II). Wytrącił się galaretowaty, niebieski osad.
b) Napisz w formie jonowej skróconej równanie reakcji, która zaszła po zmieszaniu roztworów.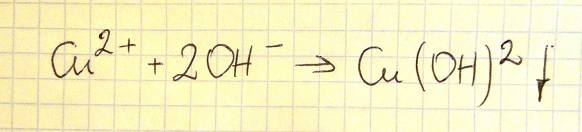
ZADANIE 18
Określ odczyn roztworów wodnych otrzymanych w probówkach oznaczonych numerami I–IV.
I. kwasowy
II. zasadowy
III. zasadowy
IV. kwasowy
ZADANIE 19
Napisz w formie jonowej skróconej równanie reakcji zachodzącej po zmieszaniu roztworów otrzymanych w probówkach I oraz III.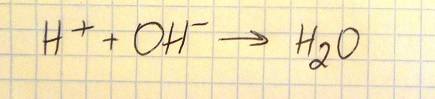
ZADANIE 20
Podaj wzór sumaryczny i nazwę soli otrzymanej w wyniku zmieszania roztworów otrzymanych w probówkach I oraz II i po odparowaniu wody.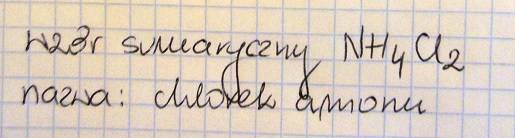
ZADANIE 21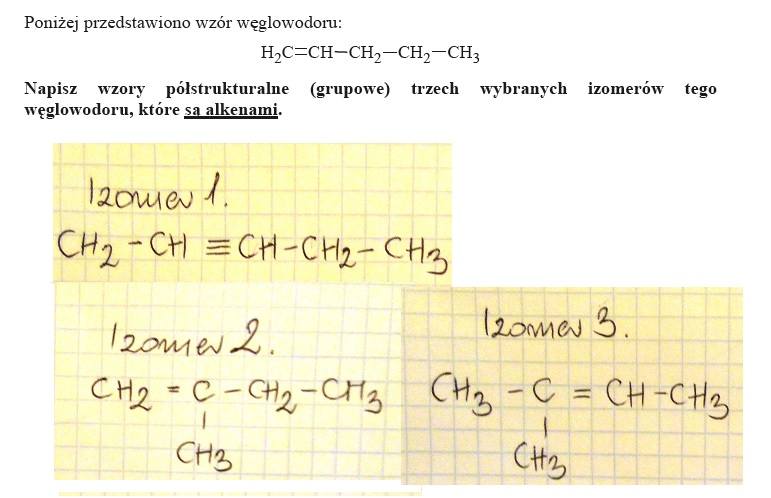
ZADANIE 22
ZADANIE 23
Oblicz, ile dm3 tlenku węgla(IV) (w przeliczeniu na warunki normalne) powstanie w wyniku całkowitego spalenia 29 gramów butanu. W obliczeniach zastosuj masy molowe zaokrąglone do liczb całkowitych.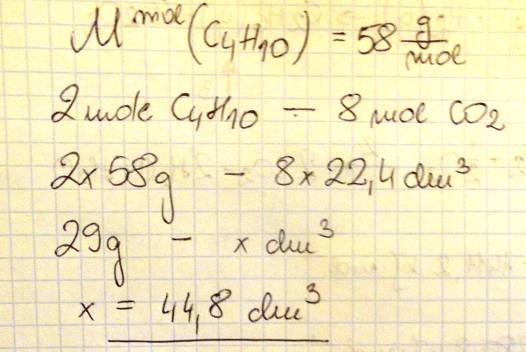
ZADANIE 24
ZADANIE 25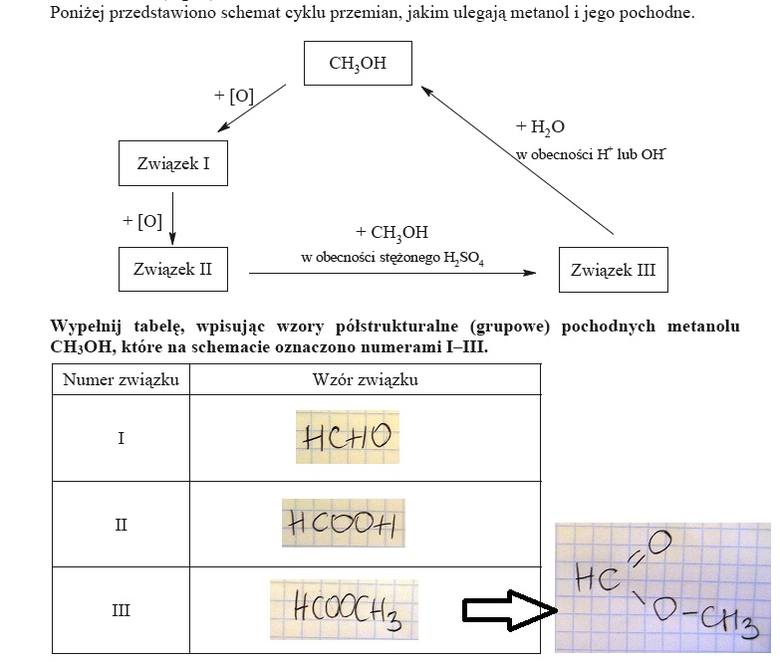
ZADANIE 26
Napisz wzór półstrukturalny (grupowy) tripeptydu utworzonego z alaniny, fenyloalaniny i glicyny, w którym sekwencja reszt aminokwasów jest następująca: Ala-Phe-Gly.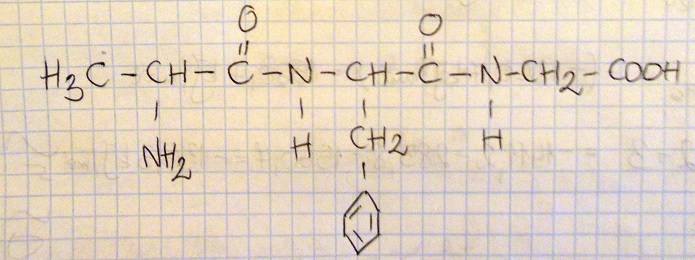
ZADANIE 27
Napisz w formie cząsteczkowej równanie reakcji alaniny z wodorotlenkiem sodu. Zastosuj wzory półstrukturalne (grupowe) reagentów organicznych.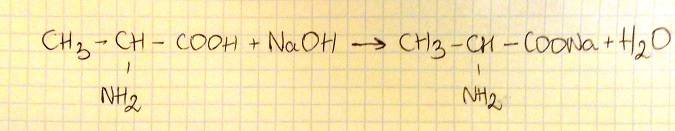
ZADANIE 28
Spośród aminokwasów wymienionych w tabeli wybierz ten, który ulega reakcji nitrowania. Napisz jego nazwę.
Fenyloalanina
ZADANIE 29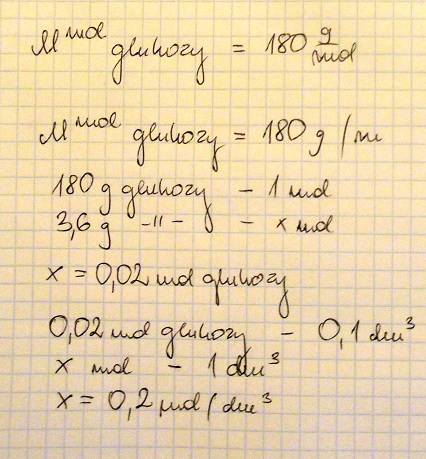
ZADANIE 30
W celu sprawdzenia obecności skrobi w badanej próbce przygotowanej z nasion pewnej rośliny wykonano eksperyment, którego przebieg przedstawiono na rysunku.
Po dodaniu kropli odczynnika o ciemnobrunatnej barwie zawartość probówki zabarwiła się na granatowo. Sformułuj wniosek o obecności skrobi w badanej próbce.
W badanej próbce roślinnej występuje skrobia.
Po raz ostatni w tym toku maturzyści mogą wybrać poziom trudności, na jakim zdają egzamin. Od matury 2015 - będzie obowiązywała tylko jeden poziom - rozszerzony.
Matura 2014 chemia - sprawdź, się przed egzaminem!
Matura 2014 z chemii - zobacz z jakich tablic możesz korzystać!
Matura 2014 z chemii na poziomie podstawowym trwa 120 minut, na poziomie rozszerzonym - 150.
MATURA 2014 - TU ZNAJDZIESZ WSZYSTKO: TERMINY, PRZECIEKI, ARKUSZE, ODPOWIEDZI
Dołącz do nas na Facebooku!
Publikujemy najciekawsze artykuły, wydarzenia i konkursy. Jesteśmy tam gdzie nasi czytelnicy!
Dołącz do nas na X!
Codziennie informujemy o ciekawostkach i aktualnych wydarzeniach.
Kontakt z redakcją
Byłeś świadkiem ważnego zdarzenia? Widziałeś coś interesującego? Zrobiłeś ciekawe zdjęcie lub wideo?
![Matura 2014: Chemia [ODPOWIEDZI, ARKUSZ CKE] - podstawa](https://d-art.ppstatic.pl/kadry/k/r/1/4d/07/5374b99b7733e_o_medium.jpg)




